
1、临床风险事件的管理和控制
ADC药物由大分子单克隆抗体、连接子和小分子的细胞毒药物偶联而成。由于抗体、连接子和细胞毒性药物不同,各ADC 药物的不良反应存在差异。按照不良反应发生的不同系统将三款ADC药物常见的不良反应进行分类,为皮肤反应、眼毒性、消化道反应、血液学毒性、神经毒性、肝毒性、肺毒性、代谢异常以及其他不良反应等,总体不良反应情况见表1。
表1:三款ADC药物不良反应表
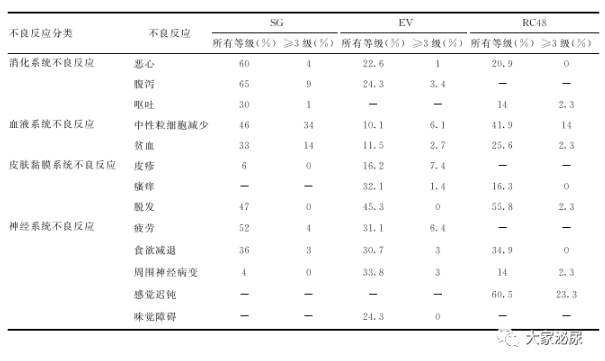
数据来源:SG AE数据来自TROPHY-U-01研究;EV AE数据来自EV 301研究;RC48 AE数据来自C005研究
1.1、皮肤黏膜系统不良反应
1.1.1、皮肤反应
皮肤不良反应多见于EV治疗的患者,EV导致的皮肤反应发生率为43. 9%,其中20. 3%为严重皮肤反应,常见反应包括皮疹、瘙痒、皮肤干燥、斑丘疹等,严重反应包括大疱性皮炎、剥脱性皮炎,还可能发生中毒性表皮坏死综合征(Stevens-Johnson syndrome,SJS) 和中毒性表皮坏死(toxic epidermal necrolysis, TEN)。大部分皮肤反应在EV治疗第一周期即出现,少部分在后续治疗中发生。应用SG的患者发生皮疹的比例为6%,而在使用RC48治疗的患者中,发生瘙痒的比例为16.3%。ADC药物治疗期间应监测患者皮肤状况,同时关注有无口腔黏膜炎和结膜炎,在有临床指征时考虑使用局部皮质类固醇和抗组胺药。对于覆盖 10%-30%体表面积的2级皮肤反应应高度警惕,如果进一步加重恶化,或覆盖30%以上面积的3级皮肤反应,应暂停使用ADC药物治疗,尽快就诊皮肤专科进行治疗直至皮肤状况改善或解决,再考虑在药物支持情况下恢复ADC药物使用。对于出现4级或复发性3级皮肤反应的患者,应当立即请皮肤专科医生诊治并永久停用ADC药物治疗。
1.1.2、眼毒性
EV导致的眼部疾病发生约为40%,需重点关注,包括角膜炎、视力模糊、流泪增多、结膜炎及干眼症等。发病到出现症状性眼疾的中位时间为1.6 个月(0.3-19.1月)。使用EV治疗期间应监测患者的眼部状况,可考虑使用人工泪液进行干眼症预防。若眼部症状出现或未得到解决,应进行眼科评估。若眼科检査后显示有必要,可考虑使用局部类固醇药物治疗。对于有症状的眼部疾病,应考虑中断或减EV剂量。
1.2、消化系统不良反应
主要包括消化道反应和肝毒性反应。消化道反应包括恶心、呕吐、纳差和腹泻等。SG导致恶心、呕吐和腹泻的发生率分别为60%、 30%和65%。使用EV治疗的患者发生恶心和腹泻的比例分别23%和24%,而使用RC48治疗恶心和呕吐的发生率为21%和14%,腹泻则罕见发生。对于恶心、呕吐,可应用止吐药物进行预防。由于SG导致的腹泻发生率为65%,需要格外关注,腹泻分为早发性和迟发性两种,早发性腹泻是因为胆碱能作用所致,通常是暂时的,可同时伴有流涎增多、出汗、心动过缓和肠蠕动亢进引起的腹部绞痛。对于短时间内出现胆碱能综合征的患者可静脉或皮下注射阿托品。迟发型腹泻通常在应用24h后发生,持续时间可能较长,可导致脱水、电解质紊乱或感染。一旦发生迟发性腹泻需及时给予易蒙停治疗,在出现粪便不成形、稀便或排便频率增多时即开始治疗。首剂4mg,之后每2h给予2mg直至腹泻停止后12h,同时维持水和电解质平衡。不推荐连续使用以上剂量易蒙停超过48h,因为有出现麻痹性肠梗阻的风险。
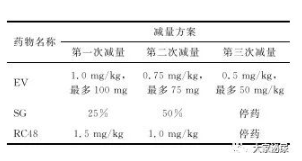
肝毒性反应中转氨酶升高为常见不良反应,部分伴有胆红素升高。EV、SG和RC48报道的谷丙转氨酶(alanine aminotranferase, ALT)或谷草转氨酶(aspartate aminotransferase, AST)升高的比例分别为9%-12%、26%-28%和32. 6%,且绝大多数为轻到中度,经保肝对症治疗后多能快速恢复。若患者发生药物相关的≥3级转氨酶升高,建议每周2次进行血生化检査;若患者在暂停用药28d后仍未恢复至常见不良反应评价标准(Common Terminology Criteria for Adverse Events, CTCAE)评分为0-2级或开始治疗前水平,则建议停止治疗,参见表2。对使用上述药物治疗的患者进行常规肝功能监测,并在发生肝功能异常时及时进行干预。
表2 :ADC药物用药减量方案
1.3、血液系统不良反应
ADC药物常见的血液系统不良反应包括中性粒细胞减少症、 贫血、血小板减少症,主要与偶联的细胞毒药物导致的骨髓抑制有关。
SG发生任意级别中性粒细胞减少的比例为46%,其中34%为3级及以上,10%发生中性粒细胞减少性发热,因此给药期间需要密切监测血液学毒性。EV和RC48发生中性粒细胞减少的比例分别为10%和41.9%,其中3级以上为6%和14%。在任意治疗周期的第1天,绝对中性粒细胞计数低于1500/mm³;或任意治疗周期的第8天,中性粒细胞计数低于1000/mm³;或应暂停使用SG。出现发热性中性粒细胞减少症时,给予经验性抗生素治疗并完善病原学检査,并考虑预防性应用升白细胞药物。
SG贫血发生率为33%,其中3级以上者占14% ;EV和RC48贫血发生率分别为12%和26%,3级以上发生率较低;三者发生血小板较少的比例都相对较低。贫血和血小板减少可依据一般化疗药物处理原则进行,必要时给予输血和药物支持治疗。
1.4、神经系统不良反应
EV和RC48均有导致周围神经病变的风险,EV报道的发生率33.8%, RC48为14%,与其偶联的微管蛋白抑制剂MMAE相关。同时,使用RC48治疗的患者中有60.5% 发生感觉迟钝。SG在尿路上皮癌中报道的周围神经病变的发生率仅为4%。周围神经病变发生率与药物剂量相关,均以1-2级周围神经病变为主。
在接受EV和RC48治疗过程中,应积极监测是否有周围神经病变发生。周围神经病变分为感觉神经病变和运动神经病变,感觉神经病变包括各种感觉减退、感觉过敏、感觉倒错和烧灼性疼痛等各种神经痛的症状;运动神经病变主要为四肢无力,严重者可出现站立不稳、无法行走,甚至卧床。当患者出现周围神经病变时,可给予甲钴胺及其他B族维生素营养神经治疗;对于神经痛,可选择普瑞巴林、阿替林、 文拉法辛或度洛西汀等对症治疗,并请神经内科协助诊治。当治疗过程中出现较为严重的周围神经病变(2级及以上)时,如肢体无力、行走不稳,或因肢体麻木疼痛,经对症治疗后仍影响日常生活时,应暂缓ADC药物治疗;如症状改善,患者能够生活自理时, 可考虑重新开始治疗,并调整ADC药物剂量至下一剂量水平(详情参见表2);若症状无明显改善应建议永久性停药。周围神经病变一旦出现恢复时间较长,建议密切监测及时进行减量或停药处理。
此外,EV和RC48偶联的MMAE可能具有植物神经毒性,从而诱发麻痹性肠梗阻。RC48报道的肠梗阻发生率约为5. 3%,在用药过程中需注意保持大便通畅。一旦发生肠梗阻需暂时停药、灌肠通便,待肠道功能恢复后再继续给药。
1.5、呼吸系统不良反应
三款药物均为肺毒性反应,罕见报道。若联合PD-1单抗治疗时,药物性肺损伤的发生率可能升高,多表现为间质性肺病(interstitial lung damage, ILD)。
在接受ADC药物联合免疫治疗期间,如患者有出现咳嗽、呼吸困难、发热和/或任何新的恶化呼吸道症状时,应立即报告,同时密切关注患者是否具有ILD的症状、体征和影像学改变,及时发现ILD的证据,可疑ILD患者应及时请呼吸科会诊并指导进一步的治疗。
1.6、代谢系统不良反应
常见不良反应包括血糖升高以及血甘油三酯升高。使用EV的受试者中约14%出现血糖升高,7%为3级或4级。在使用RC48治疗的患者中,11.6%发生血糖升高, 23.3%发生血甘油三酯升高,均为轻度不良反应。 SG在尿路上皮癌中报道的血糖升高发生率<1%且≤2级。
EV治疗期间密切关注可能患有糖尿病或高血糖的患者的血糖水平;但同样需要关注既往没有糖尿病病史的患者,若血糖升高(> 13.9mmol/L),应暂停治疗,并警惕出现血糖升高相关的酮症酸中毒。在血糖降至<13. 9mmol/L后,可考虑恢复同一剂量水平的ADC药物治疗并加强血糖监测和降糖治疗。RC48所导致的高血糖参考以上原则。
专家共识推荐:ADC药物由于独特的组织结构与作用机制,不同于既往的化疗药物、靶向药物以及免疫治疗药物,其不良反应主要来自针对靶点的单克隆抗体产生脱靶效应以及偶联的细胞毒药物等,可累及多个脏器系统,严重者可威胁生命,处理不良反应过程中应充分结合多学科会诊机制,早期发现、及时处理,避免出现严重的不良反应。
EV靶向的Nectin-4分子在正常皮肤组织和角膜上皮的表达有关,因此应用EV时需要特别关注皮肤反应和眼毒性,定期进行皮肤科和眼科的评估。而针对ADC药物偶联细胞毒药物导致的不良反应中,消化道反应、骨髓抑制、神经毒性是常见不良反应。 SG导致的腹泻与中性粒细胞减少发生率比较高,而EV和RC48需要特别关注是神经毒性。对于ADC 药物联合PD-1/PD-L1单抗等治疗,需重视可能合并更重的不良反应,应高度警惕。
2、减量及停药原则
ADC药物相关不良反应根据CTCAE发生级别的不同进行减量或停药的处理(表2)。重视特殊的不良反应,建立并积极开展MDT会诊,保障患者的用药安全。总体原则是1级不良反应可继续用药;2级不良反应绝大多数可维持原剂量继续用药,部分毒副反应如血小板减少、神经毒性及角膜病变需暂停用药,待恢复至1级后继续用药;3级不良反应,应及时暂停ADC药物治疗,在不良反应恢复至1级后给予减量治疗;4级不良反应或反复多次发生3级反应则应考虑停止治疗(表3)。
表3:ADC药物剂量调整基本原则

专家共识推荐:对于ADC药物应用过程中可能发生的不良反应,治疗前应给予积极预防治疗;用药后应密切监测相关不良反应,及时诊断并给予对应处置方案,同时重新评估药物治疗方案,必要时进行延期治疗或减量处理;对于严重不良反应要及时停药,积极开展多学科会诊,探讨解决方案。
3、特殊人群处理
对于糖尿病患者,EV 和RC48报道的血糖升高发生率均超过10%,SG报道的血糖升高发生率不到1%。建议糖尿病患者将血糖控制稳定后再开始治疗。患有活动性角膜炎或角膜溃疡的患者不建议应用EV治疗。肾功能不全患者,包括重度肾功能不全(肌酊清除率<30mL/min)无需调整EV剂量。SN-38几乎不从肾进行清除,但对于肾功能不全或终末期肾病无药代动力学数据。RC48在轻、中度肾功能损害患者无需剂量调整,但尚无重度肾功能损害研究数据。
专家共识推荐:对于ADC药物治疗前患者的基础器官功能需进行充分评估,对于有特定基础疾病的患者需排除禁忌证后在严密监测下应用,保障患者的用药安全。
来源:中国医疗保健国际促进交流会泌尿健康促进分会,中国研究型医院学会泌尿外科学专业委员会.尿路上皮癌抗体偶联药物临床应用安全共识(第一版)[J].现代泌尿外科杂志, 网络首发.