
肾母细胞瘤又称Wilms瘤、胚胎瘤、癌肉瘤、腺肉瘤以及腺肌肉瘤,主要发生于婴幼儿,90%出现于6岁以前。发生于成人的肾母细胞瘤极为少见,其病理学特点和治疗原则与儿童肾母细胞瘤相同。本文报 道1例成人肾母细胞瘤(AWT)。
【病例资料】
男性,43岁,行B超检查发现左肾占位性病变,无腰部疼痛,无肉眼血尿,为求进一步治疗入院。体格检查:左肾下极可触及肿大包块,活动度可,无压痛。
【辅助检查】
增强CT
左侧肾实质可见一约4.0 cm×3.5 cm大小的团状不规则阴影,左侧肾盂积水,肾皮质受压略变薄;双侧肾上腺可见不规则密度阴影。
静脉肾盂造影
左肾影未见显示。
【诊疗经过】
入院行手术治疗,术中见:左肾大,形状不规则,中部可触及一包块,约3.0 cm×3.0 cm,质硬,固定;左侧肾上腺区可触及一包块,约5.0 cm×5.0 cm,质硬;右侧肾上腺区可触及一包块,约3.0 cm×4.0 cm,质硬;腹腔内三处肠系膜淋巴结肿大,约3.0 cm×3.0 cm。
取手术标本,所有组织均用4%甲醛液固定。常规石蜡包埋,5 μm切片行HE染色,并做Vimentin、SM-actin、CK、CK18、EMA、CD34和CEA等免疫组化染色(SP法)。
结果显示
巨检:左肾切除标本,体积12.0 cm×8.5 cm×5.5 cm,局部已剖开,在肾中极可见一灰白结节,体积5.0 cm×4.0 cm×4.0 cm,切面灰白,质中,侵及肾实质全层,并累及肾周脂肪组织。镜检:瘤组织主要由3种成分组成,低倍镜下见典型的胚芽组织、间胚叶间质和幼稚的肾小管、肾小球结构(图1A) ,高倍镜下可见未分化胚芽组织和间胚叶性间质混杂存在(图1B)。免疫组化:肿瘤细胞表达Vimentin(+++)(图1C)、SM-actin(++)、CK(++)(图1D)、CK18(+)、EMA(+)、CD34(+),不表达 CEA(-),结果提示肿瘤组织内含有未分化胚芽组织、间胚叶性间质和上皮成分。
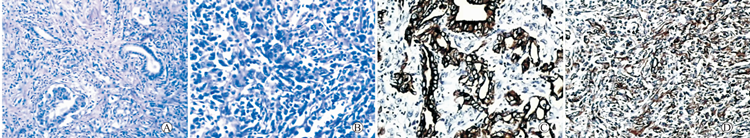
图1:成人肾母细胞瘤的病理组织学特征和免疫组化特征
A:低倍镜下的胚芽组织,间胚叶间质和幼稚的肾小管、肾小球结构(HE×100);B:高倍镜下见未分化胚芽组织和间叶性间质混杂存在(HE×200);C:部分瘤细胞胞浆CK阳性(SP×200);D:部分瘤细胞胞浆Vimentin阳性(SP×100) 。
【讨论】
关于肾母细胞瘤
1.流行病学特征
肾母细胞瘤由RANCE于1814年首先报告,1899年WILMS详细描述,因此也称作Wilms瘤(或Wilms’瘤),是小儿泌尿系统最常见的恶性肿瘤,约占小儿全部实体肿瘤的8%,但罕见于成人,TAWIL等报道AWT占全部肾母细胞瘤的1%以下。根据检索中国学术期刊全文数据库(CJFD,1994~2008年),国内多为个案或小样本报道,共报道165例。
2.临床表现
肾母细胞瘤的典型症状首先是腹部包块,偶见血尿和疼痛,少数因肿瘤分泌肾素而出现高血压。肿瘤以外的肾组织出现肾小球疾病时,可有蛋白尿,有时最先出现的症状是由于肿瘤破裂引起,有2例报告由于肿瘤栓塞而导致突然死亡。
静脉肾盂造影显示肾内肿瘤,可因压迫致使肾盂扭曲变形,超声、CT等可更确切地显示肿瘤的存在和发展。
在本例中,患者体检时行B超检查发现左肾占位性病变,CT示肾实质可见团状不规则强化阴影,肾癌不除外。患者无腰部疼痛,无肉眼血尿。大体观察呈单个实体瘤块,圆形,边界较清楚,切面湿润灰白,呈鱼肉状,可有出血、坏死及囊性变。
3.病理改变
光学显微镜检查,主要有3种基本成分:未分化的胚芽组织、间胚叶间质和上皮成分。未分化胚芽组织以小圆形细胞为主,具有圆形或卵圆形的深染细胞核,少量透明的胞浆,细胞可呈多种分布方式:弥漫性、结节状、缎带状及基底细胞样排列。间胚叶间质以梭形的成纤维细胞为主,但可向其他类型的细胞分化,尤其常呈现平滑肌和横纹肌细胞。上皮成分的特点是形成胚胎时期的肾小管和肾小球样结构。有的肾母细胞瘤可出现各种类型的内分泌细胞。
免疫组化显示多样性,胚芽组织显示Vimentin阳性,上皮成分显示CK和EMA阳性,并有基底膜成分的表现,间胚叶成分依其分化程度,可表现myoglobin、desmin、NSE、GFAP以及、S-100等阳性。
3.诊断
AWT最后确诊需术后病理,基本组织学特征是发育不全或胚胎性的肾小球、肾小管结构伴有不成熟肉瘤样间质,但SINGH等认为分化不良的AWT病理表现多变、复杂,并不典型,有些病例主要表现为不成熟的母细胞成分,无典型的胚胎性肾小球、肾小管结构,为分化不良型。
因此,必须综合年龄、性别、临床表现、影像学检查及术后病理结果才能降低AWT的误诊率。KIOUMEHR等认为小于35岁的年轻人有迅速生长的肾脏包块,B超及CT显示混合性或囊性肿块,肾动脉造影见肿瘤为少血管性分布,并有波浪状新生肿瘤血管形成,则75%~80%可能为AWT。
鉴别诊断
AWT的组织成分多样,需与以下多种疾病相鉴别,以免误诊。
①肾癌:一些肾癌可能有腺性成分和丰富的肉瘤样或未分化的细胞,容易与肾母细胞瘤相混淆,但无论成人还是儿童肾母细胞瘤都不会有肾癌中成熟的腺样结构,故可将有无原始肾小管形成作为肾母细胞瘤与其它肿瘤的胚胎成分相鉴别的依据。
②肾恶性横纹肌样瘤:本瘤婴幼儿多见,瘤细胞丰富,嗜酸性,呈腺肉瘤样排列,电镜及免疫组化未发现横纹肌分化。
③中胚叶肾瘤:肉眼肿瘤无明显包膜,与肾实质无明显分界,镜下仅含有间叶性成分,而无上皮性成分,瘤细胞无明显异型性。
④其他:如未成熟的畸胎瘤和恶性间叶瘤,两者不形成肾小管和肾小球样结构,而肾母细胞瘤多方向、多潜能使免疫组化呈多向性表达,如CK,EMA,Vimentin,NSE,S-100等阳性表达均有助诊断。
4.预后
AWT预后与多种因素有关:①年龄:2岁以下患儿的5年生存率较高;②临床和病理分期:肿瘤包膜受侵、手术时肿瘤破裂、肾外静脉受侵、肿瘤组织浸润于周围组织、淋巴结转移、远隔转移、双肾发生等,均为预后不好的指标:③体积:肿瘤的体积和重量越大,预后越差;④肿瘤细胞间变是预后不好的指标:细胞核增大、染色质增多增粗、核分裂像增多是判断间变的指征;⑤有肾小球和肾小管的分化特征是预后好的指征;⑥呈囊状结构者,预后良好;⑦大量横纹肌分化时,预后好;⑧产生黏液,预后不好;⑨DNA多倍性,对判断预后很有帮助,但尚无明确的结论。
来源:韩秀娟,巩丽,薛力,等.成人肾母细胞瘤1例及文献复习(J).现代泌尿外科杂志,2010,15(1):17-19.